en la enfermedad celíaca (corriente continua), la gluten desencadena un proceso autoinmune que daña la mucosa del intestino delgado y, actualmente, no hay medicina para el enfermedad celíaca, simplemente una dieta totalmente libre de gluten.
de estudios, el grupo COUR (Científicos profesionales que buscan encontrar tratamientos y curas para enfermedades inmunomediadas.), desarrolló una nanopartícula capaz de causar tolerancia al gluten en el cuerpo del celíaco.
Una empresa farmacéutica de Takeda, una empresa farmacéutica de japón, tras la divulgación de COUR de su éxito en la creación de la nueva nanopartícula, demostró sus intereses y compró los derechos del medicamento., iniciar estudios clínicos.
¿Cómo funciona el medicamento para la enfermedad celíaca CNP-101 / TAK-101?
Un CNP-101 (TIMP-GLIA) es una nanopartícula biodegradable que encapsula la proteína gliadina – componente desencadenante principal del CD. Esta nanopartícula actúa como “Caballo de Troya”, ocultar el alérgeno dentro de la cápsula, para convencer al sistema inmunológico de que no lo ataque.
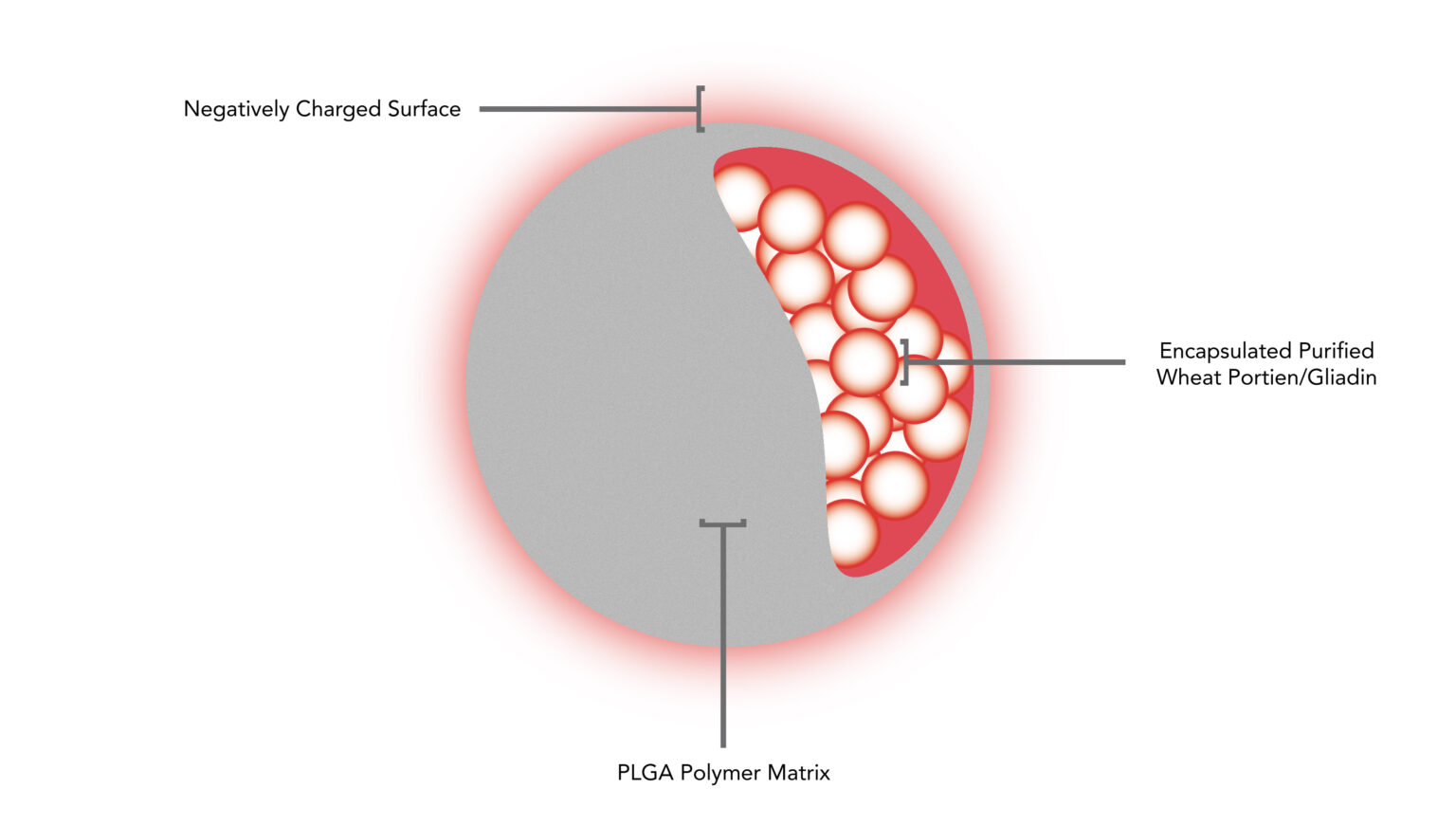
Cuando la nanopartícula cargada de alérgenos se inyecta en el torrente sanguíneo, el sistema inmunológico no está preocupado por ella, porque lo ves como escombros inofensivos. Naturalmente, la nanopartícula es consumida por un macrófago. (célula de defensa del cuerpo). Como a cápsula PLGA – escuela politécnica(ácido láctico-co-ácido glicólico) está hecho de un material altamente biodegradable y biocompatible., y el alergeno es “escondido”, el sistema inmunológico apaga el ataque y se restablece a su funcionamiento normal..
Además de la enfermedad celíaca, la tecnología podría potencialmente manejar una serie de otras enfermedades y alergias, incluida la esclerosis múltiple, diabetes tipo 1, Alergia al maní, asma y más. La tecnología fue desarrollada en el laboratorio de laDr. Stephen Miller, profesor de microbiología e inmunología en Northwestern University.
Hasta ahora, el medicamento se ha probado en una fase aleatorizada y doble ciego. 2 para evaluar la eficacia y seguridad de CNP-101 en la dosificación de 8 mg / kg versus placebo en pacientes celíacos.
Curiosidad: que haces en una fase 2 de estudio clínico?
fase de estudio 2 normalmente engloba: de 100 un 300 individuos que padecen la enfermedad para la que se está estudiando el fármaco. El objetivo es obtener más datos de seguridad y comenzar a evaluar la efectividad del nuevo medicamento.. Suelen probar diferentes dosis e indicaciones.
UNICAMP – Facultad de ciencias medias
El estudio
El desafío del gluten ha comenzado 7 días después de la administración de dos dosis de prueba para “desactivación” del sistema inmunológico. El tratamiento incluido 12 g de gluten por día para 3 días seguidos y más tarde, 6 g / día de gluten durante 11 día. La endoscopia se realizó antes del tratamiento y al final de la provocación con gluten..
Un total de 34 los pacientes fueron aleatorizados y tratados; seis interrumpieron el estudio debido a síntomas relacionados con el gluten y 28 Completó el protocolo completo de 14 día. Ningún paciente presentó cambios clínicos significativos en los signos vitales., pruebas de laboratorio de rutina o citocinas / quimiocinas séricas, Proliferación de células T específicas de gliadina y secreción de citocinas.. Los niveles de complemento (complejo de células de defensa que participan en defensas innatas y adquiridas) aumento de los niveles plasmáticos en la mayoría de los pacientes; sin embargo, este efecto transitorio no se reflejó en los eventos adversos asociados.
Los eventos adversos más frecuentes observados en pacientes tratados con CNP-101 con el valor correspondiente entre paréntesis para pacientes tratados con placebo fueron: náusea 81% (72%), distensión abdominal 56% (61%), Diarrea 50% (50%), dolor de cabeza 44% (17%), dolor abdominal 38% (28%), sonidos gastrointestinales anormales 38% (39%), vomitando 31% (33%), fatiga 31% (50%) y dolor de espalda 31% (0).
Comparación de los grupos de intervención y placebo:
Comparación del grupo de intervención y el grupo de placebo, el grupo de intervención obtuvo 4 síntomas más agravados versus 4 síntomas en el grupo placebo y 1 empate. Aunque el porcentaje de síntomas parece aterrador, el propósito del estudio se completó con éxito. Por otra parte, el grupo placebo mostró una reducción en la altura de las vellosidades intestinales en la endoscopia realizada después del final del estudio.
Por fin, El estudio mostró que la medicación CNP-101 pudo prevenir la activación inmunitaria inducida por la ingestión de gluten en adultos con EC. Hasta donde sabemos, Este es el primer ensayo clínico que demuestra la inducción no autóloga de tolerancia inmune específica de antígeno en cualquier enfermedad autoinmune..
Y ahí, ¿Tomaría este medicamento para la enfermedad celíaca si estuviera aprobado?? Dime en los comentarios!
Vea aquí el artículo original sobre el medicamento para la enfermedad celíaca.
Resúmenes de última hora (wiley.com) Disponible en la página 11
Extractos del formato Takeda (courpharma.com)
