Na doença celíaca (DC), o glúten desencadeia um processo autoimune que leva à lesão da mucosa do intestino delgado e, atualmente, não existe nenhum medicamento para a doença celíaca, apenas dieta totalmente livre de glúten.
A partir de estudos, o grupo COUR (profissionais cientistas que buscam encontrar tratamentos e curas para doenças imunomediadas), desenvolveram uma nanopartícula capaz de causar tolerância ao glúten no organismo do celíaco.
A Takeda Pharmaceutical Company, uma companhia farmacêutica do Japão, após a divulgação da COUR de seu sucesso na criação da nova nanopartícula, demonstrou seus interesses e comprou os direitos da medicação, dando inicio aos estudos clínicos.
Como funciona o medicamento para doença celíaca CNP-101/TAK-101
A CNP-101 (TIMP-GLIA) se trata de uma nanopartícula biodegradável que encapsula a proteína gliadina – principal componente desencadeante da DC. Essa nanopartícula atua como um “Cavalo de Tróia”, escondendo o alérgeno dentro da cápsula, afim de convencer o sistema imunológico a não atacá-lo.
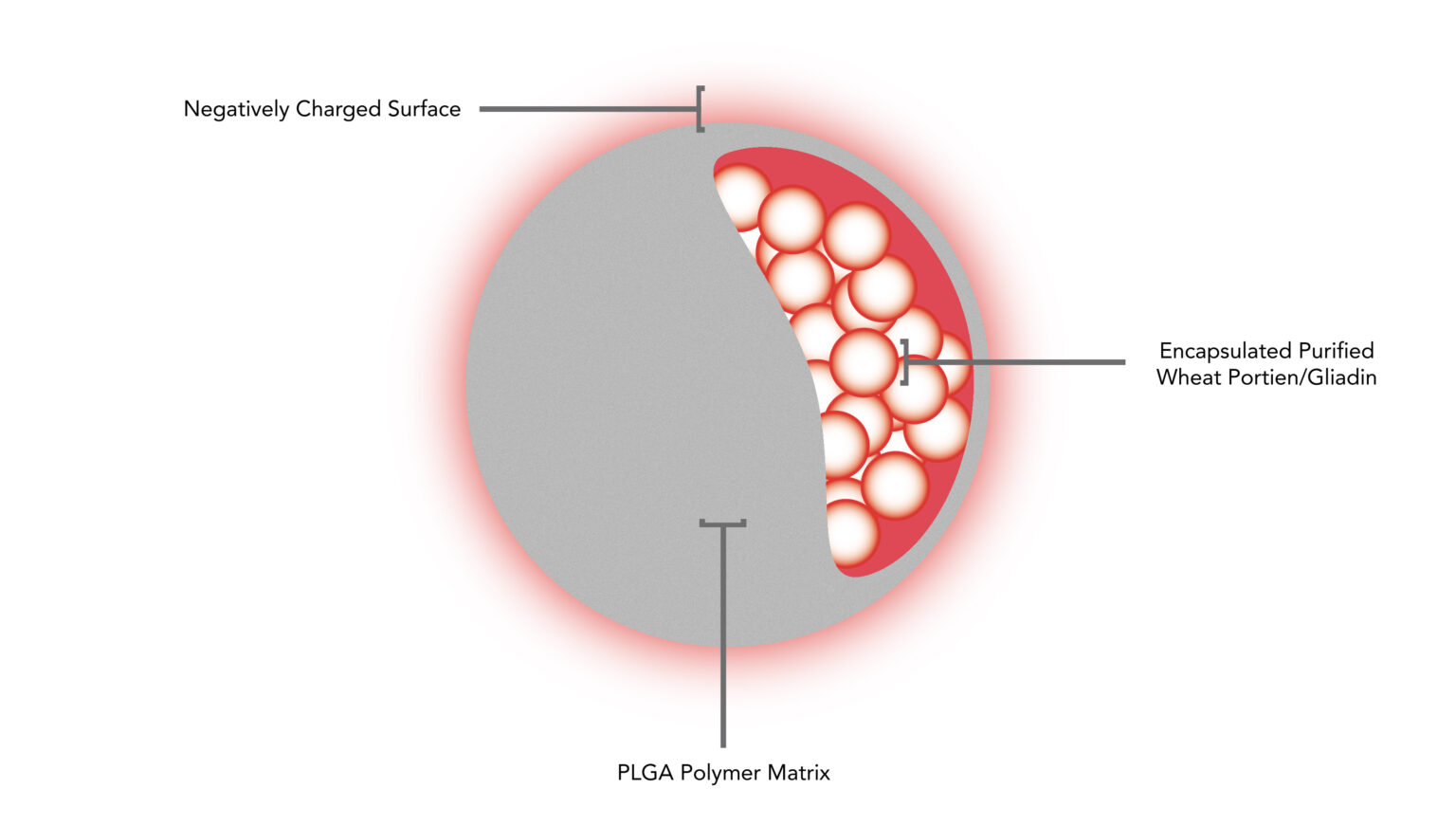
Quando a nanopartícula carregada de alérgeno é injetada na corrente sanguínea, o sistema imunológico não está preocupado com ela, pois a vê como detritos inofensivos. Naturalmente a nanopartícula é consumida por um macrófago (célula de defesa do corpo). Como a cápsula PLGA – poli(ácido lático-co-ácido glicólico) é feita de um material altamente biodegradável e biocompatível, e o alérgeno está “escondido”, o sistema imune desliga o ataque e é redefinido para sua atuação normal.
Além da doença celíaca, a tecnologia potencialmente poderá tratar uma série de outras doenças e alergias, incluindo esclerose múltipla, diabetes tipo 1, alergia ao amendoim, asma e muito mais. A tecnologia foi desenvolvida no laboratório do Dr. Stephen Miller, professor de microbiologia e imunologia da Universidade Northwestern.
Até agora a medicação foi testada em estudo duplo-cego randomizado de Fase 2 para avaliar a eficácia e segurança de CNP-101 na dosagem de 8 mg/kg versus placebo em pacientes celíacos.
Curiosidade: o que se faz em uma fase 2 de estudo clínico?
Estudo fase 2 normalmente engloba: de 100 a 300 indivíduos que têm a doença para a qual o medicamento está sendo estudado. O objetivo é obter mais dados de segurança e começar a avaliar a eficácia do novo medicamento. Geralmente testam diferentes dosagens e indicações.
UNICAMP – Faculdade de Cíências Médias
O estudo
O desafio do glúten começou 7 dias após a administração de duas dosagens testes para “desativação” do sistema imune. O tratamento incluiu 12 g de glúten por dia durante 3 dias seguidos e posteriormente, 6 g/dia de glúten durante 11 dias. A endoscopia foi realizada antes do tratamento e no final do desafio do glúten.
Um total de 34 pacientes foram randomizados e tratados; seis interromperam o estudo por conta de sintomas relacionados ao glúten e 28 completaram o protocolo completo de 14 dias. Nenhum paciente apresentou alterações clinicas significativas nos sinais vitais, exames laboratoriais de rotina ou citocinas / quimiocinas séricas, proliferação de células T específicas da gliadina e secreção de citocinas. Os níveis de complemento (complexo de células de defesa que participam das defesas inatas e adquiridas) plasmático aumentaram na maioria dos pacientes; no entanto, esse efeito transitório não foi refletido em eventos adversos associados.
Os eventos adversos mais frequentes observados em pacientes tratados com CNP-101 com o valor correspondente entre parênteses para pacientes tratados com placebo foram: náusea 81% (72%), distensão abdominal 56% (61%), diarreia 50% (50%), dor de cabeça 44% (17%), dor abdominal 38% (28%), sons gastrointestinais anormais 38% (39%), vômitos 31% (33%), fadiga 31% (50%) e dor nas costas 31% (0).
Comparando os grupos intervenção e placebo:
Comparando grupo intervenção e grupo placebo, o grupo intervenção obteve 4 sintomas mais agravados versus 4 sintomas no grupo placebo e 1 empate. Apesar do percentual de sintomas parecer assustador, o objetivo do estudo foi concluído com sucesso. Além disso, o grupo placebo apresentou redução na altura das vilosidades intestinais na endoscopia feita após finalização do estudo.
Por fim, o estudo mostrou que a medicação CNP-101 foi capaz de prevenir a ativação imune induzida pela ingestão de glúten em adultos com DC. Até onde sabemos, este é o primeiro ensaio clínico a demonstrar indução não autóloga de tolerância imunológica específica ao antígeno em qualquer doença autoimune.
Eai, você tomaria esse medicamento para doença celíaca se fosse aprovado? Me conta nos comentários!
Veja aqui o artigo original sobre o medicamento para doença celíaca
Late breaking abstracts (wiley.com) Disponível na página 11
Excerpts Takeda format (courpharma.com)
